Actualización 03/02/2023 9:05 a. m.: Esta historia se ha actualizado para incluir la información de retirada.
Una cepa bacteriana ampliamente resistente a los medicamentos se está propagando en los EE. UU. por primera vez y está causando un brote alarmante relacionado con las lágrimas artificiales, según una alerta emitida el miércoles por la noche por los Centros para el Control y la Prevención de Enfermedades. Hasta el momento, el germen ha causado varias infecciones en 55 personas en 12 estados, matando a una y dejando a otras hospitalizadas y con pérdida permanente de la visión.
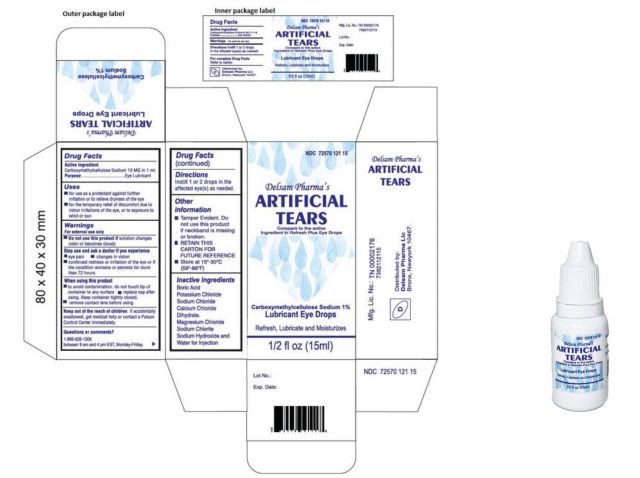
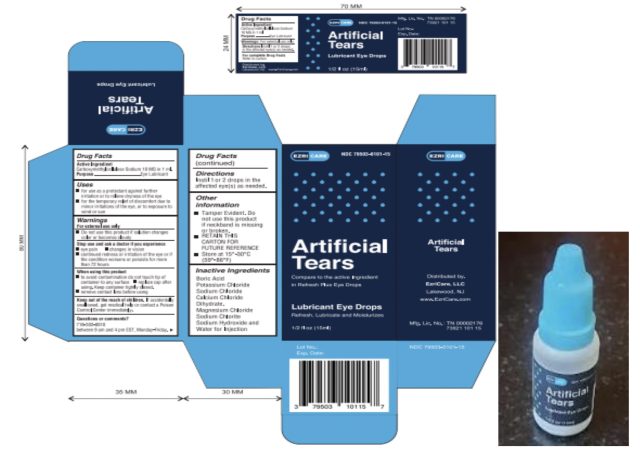
Los pacientes infectados informaron haber usado más de 10 marcas de lágrimas artificiales en conjunto, y algunos pacientes usaron varias marcas. Pero la marca más común utilizada entre los pacientes fue EzriCare Artificial Tears, un producto sin conservantes vendido por Walmart, Amazon y otros minoristas.
El jueves, después de que esta historia se publicara originalmente, la Administración de Alimentos y Medicamentos (FDA, por sus siglas en inglés) publicó un aviso de retiro del mercado de las lágrimas artificiales de EzriCare y las lágrimas artificiales de Delsam Pharma. La FDA y los CDC recomiendan a los médicos y pacientes que dejen de comprar y usar los dos productos. En un aviso separado, la FDA agregó además que el fabricante de los productos, Global Pharma Healthcare Private Limited, violó las buenas prácticas de fabricación, incluida la falta de pruebas microbianas adecuadas, la formulación de su producto sin un conservante adecuado y la falta de controles adecuados con respecto a embalaje a prueba de manipulaciones.
Enemigo formidable
El culpable detrás del brote es una cepa de Pseudomonas aeruginosa, una bacteria extremadamente versátil, innatamente resistente a los medicamentos que acecha en el medio ambiente, particularmente en agua dulce. Se sabe que causa diversas infecciones de la piel, heridas, quemaduras, pulmones y sistémicas. Afecta con mayor frecuencia a personas en estados inmunocomprometidos, como aquellos con fibrosis quística, y tiene la reputación de provocar brotes en entornos de atención médica, particularmente entre personas con dispositivos permanentes, como catéteres y tubos de respiración. En entornos hospitalarios, se esconde en fregaderos, máquinas de hielo, lavadoras de dispositivos, equipos de terapia respiratoria y en pastillas de jabón.
En el brote actual, 35 de los 55 pacientes infectados estaban vinculados a cuatro grupos de casos en centros de atención médica. Entre esos cuatro grupos asociados a la atención médica, el producto EzriCare Artificial Tears fue el único producto común entre las instalaciones. Los investigadores de los CDC también encontraron el brote. P. aeruginosa cepa en envases abiertos de botellas de EzriCare Artificial Tears, que se fabricaron en diferentes lotes y se recolectaron de pacientes en dos estados diferentes.
La cepa del brote es una cepa rara, ampliamente resistente a los medicamentos con un bocado de nombre: Verona Integron-mediated Metalo-β-lactamase (VIM) y Guayana-Extended Spectrum-β-Lactamase (GES)-resistentes a la producción de carbapenem P. aeruginosa—o VIM-GES-CRPA para abreviar.
Aunque multirresistente P. aeruginosa Las cepas han representado durante mucho tiempo una amenaza en los EE. UU. y en otros lugares, esta es la primera vez que se encuentra que VIM-GES-CRPA se propaga en los EE. UU. La cepa es resistente a varias armas antibióticas, que incluyen: cefepima, ceftazidima, piperacilina-tazobactam, aztreonam, carbapenems, ceftazidima-avibactam, ceftolozano-tazobactam, fluoroquinolonas, polimixinas, amikacina, gentamicina y tobramicina, informaron los CDC.
Hasta ahora, las pruebas de susceptibilidad a los antibióticos en tres brotes aislados sugieren que la cepa VIM-GES-CRPA aún es susceptible al cefiderocol, un antibiótico más nuevo que recibió la aprobación de la FDA en 2019 para tratar infecciones del tracto urinario resistentes a múltiples fármacos.
En el brote actual, que comenzó en mayo de 2022, los investigadores aislaron la cepa del brote de 13 esputos o lavados bronquiales, 11 hisopos de córnea, siete muestras de orina, dos muestras de sangre, 25 hisopos rectales y otras cuatro fuentes no estériles. Los pacientes se presentaron en entornos de pacientes hospitalizados y ambulatorios con una variedad de infecciones. Estos incluyen infecciones oculares (infección de la córnea (queratitis) e infección del tejido o fluidos dentro del globo ocular (endoftalmitis)) hasta infecciones respiratorias, infecciones del tracto urinario y sepsis. El paciente que falleció tenía una infección sistémica.
Los casos hasta ahora ocurrieron en 12 estados: California, Colorado, Connecticut, Florida, Nueva Jersey, Nuevo México, Nueva York, Nevada, Texas, Utah, Washington y Wisconsin.
Respuesta
En una declaración del 1 de febrero, EzriCare, LLC dijo que está cooperando con los CDC y la FDA en la investigación. «Hasta el día de hoy, no tenemos conocimiento de ninguna prueba que vincule definitivamente la Pseudomonas aeruginosa brote a EzriCare Artificial Tears», dijo la compañía. «Sin embargo, inmediatamente tomamos medidas para detener cualquier distribución o venta de EzriCare Artificial Tears. En la mayor medida posible, nos hemos puesto en contacto con los clientes para desaconsejarles el uso continuado del producto».
EzriCare señaló que solo tiene una participación limitada con el producto de lágrimas artificiales, que también se comercializa con otras marcas, señaló la compañía, sin identificar ninguna otra marca. «El único rol de EzriCare, LLC en la introducción del producto al mercado fue diseñar una etiqueta exterior y comercializarla entre nuestros clientes», dijo la compañía. Las gotas para los ojos son fabricadas en India por Global Pharma Healthcare PVT Limited e importadas a los Estados Unidos por Aru Pharma Inc.
Global Pharma Healthcare publicó un comunicado de prensa en su sitio web con fecha del 1 de febrero diciendo que está retirando voluntariamente sus productos de lágrimas artificiales.