La Administración de Alimentos y Medicamentos aprobó el viernes dos terapias genéticas para tratar la anemia de células falciformes, una de las cuales es el primer tratamiento basado en CRISPR/Cas9 que obtiene la aprobación regulatoria en los EE. UU.
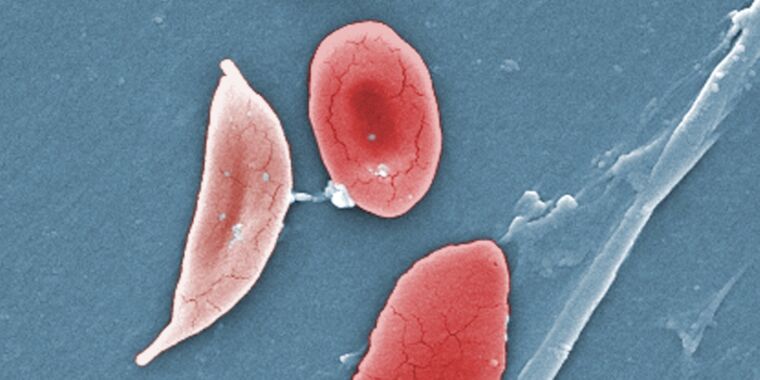
El anuncio es un hito en el tratamiento de la anemia de células falciformes, una enfermedad devastadora en la que los glóbulos rojos se deforman hasta adoptar la forma de una hoz y obstruyen los vasos sanguíneos. La anemia falciforme afecta a unas 100.000 personas en Estados Unidos, la mayoría de ellas afroamericanas. Conduce a anemia, eventos vasooclusivos y crisis (episodios dolorosos en los que pequeños bloqueos privan de oxígeno al tejido), accidentes cerebrovasculares, daño orgánico progresivo e irreversible, disminución de la calidad de vida y muerte prematura.
Hasta hoy, los tratamientos han sido limitados. Un trasplante de médula ósea de un hermano genéticamente compatible puede curar la afección más del 90 por ciento de las veces, pero sólo alrededor del 20 por ciento de las personas con la enfermedad tienen un hermano donante genéticamente compatible. También hay múltiples medicamentos disponibles y cuidados de apoyo, pero principalmente reducen la gravedad de la enfermedad. Los nuevos tratamientos de terapia génica, por otro lado, han demostrado ser muy eficaces para prevenir eventos y crisis vasooclusivas.
«La anemia de células falciformes es un trastorno sanguíneo poco común, debilitante y potencialmente mortal con una importante necesidad insatisfecha, y estamos entusiasmados de avanzar en este campo, especialmente para las personas cuyas vidas se han visto gravemente alteradas por la enfermedad, mediante la aprobación de dos terapias genéticas basadas en células. hoy», dijo Nicole Verdun, directora de la Oficina de Productos Terapéuticos dentro del Centro de Evaluación e Investigación Biológica de la FDA, en el anuncio de la FDA.
Para comprender cómo funcionan las terapias genéticas, es útil comprender qué causa la anemia de células falciformes. El problema central es la hemoglobina adulta, la proteína que contiene hierro en los glóbulos rojos y que transporta oxígeno desde los pulmones al resto del cuerpo. En los pacientes con anemia de células falciformes, hay una única y pequeña mutación en el gen que codifica la hemoglobina. La mutación es un cambio de un solo nucleótido o base (a menudo representado por las letras A, C, T y G). El cambio de una A a una T en el código genético de la hemoglobina da como resultado una proteína de hemoglobina con una valina en lugar de un ácido glutámico en la posición del sexto aminoácido. Esto transforma la hemoglobina adulta normal (HbA) en hemoglobina falciforme (HbS). En los glóbulos rojos, cuando la HbS pierde el oxígeno que transportaba, se polimeriza consigo misma formando estructuras en forma de hebras que deforman la célula.
Ediciones efectivas
La terapia CRISPR/Cas9 aprobada hoy, llamada Casgevy, previene esta deformación esencialmente activando la producción de otro tipo de hemoglobina codificada en nuestros patrones genéticos: la hemoglobina fetal (HbF). La HbF está optimizada para el embarazo, transfiriendo oxígeno de la sangre materna al tejido fetal, y el gen que la codifica se desactiva poco después del nacimiento a medida que el cuerpo realiza la transición a HbA. Aproximadamente seis meses después del nacimiento, la HbF generalmente representa sólo entre el 1 y el 2 por ciento de la hemoglobina del cuerpo.
Pero la HbF puede tratar eficazmente la anemia de células falciformes: la hemoglobina transporta oxígeno muy bien en los adultos y no se polimeriza. Además, cuando se mezcla con HbS, interfiere con la polimerización de la proteína mutada consigo misma, impidiéndole formar estructuras que deformen los glóbulos rojos.
Casgevy activa la HbF con el sistema CRISPR/Cas9, un sistema de edición de genes inicialmente extraído de bacterias que corta el ADN utilizando una enzima (una nucleasa) llamada Cas9. Cas9 puede dirigirse a tramos específicos de ADN utilizando una secuencia guía de ARN corta. En Casgevy, el sistema CRISPR/Cas9 tiene como objetivo cortar un gen que codifica una proteína llamada BCL11A, que controla otros genes, también conocido como factor de transcripción. El factor de transcripción BCL11A es la proteína responsable de desactivar el gen de la HbF poco después del nacimiento a medida que el cuerpo pasa a la versión adulta. Con el corte CRISPR/Cas9, se apaga BCL11A y se puede reanudar la producción de HbF.
Para los pacientes que reciben tratamiento, este proceso implica primero recolectar células madre de su médula ósea, que luego se someten a pruebas CRISPR en un laboratorio especializado. Mientras tanto, los pacientes reciben quimioterapia para matar las células de la médula ósea y dar paso a las células editadas genéticamente que luego se vuelven a colocar. De 31 pacientes tratados con Cagevy y seguidos durante al menos 24 meses, 29 (93,5 por ciento) recibieron al menos 12 meses consecutivos sin crisis vasooclusiva.
La otra terapia génica aprobada hoy por la FDA es Lyfgenia, que utilizó un vector lentiviral para insertar genes en el genoma humano. En este caso, el sistema entrega el código genético para un tipo modificado de hemoglobina que está diseñado para ser antifalciforme, llamado HbA.T87Q. Entre 32 pacientes tratados con Lyfgenia, 28 (88 por ciento) estuvieron libres de eventos vasooclusivos entre seis y 18 meses después del tratamiento.
Ambas terapias genéticas están aprobadas para pacientes de 12 años en adelante.