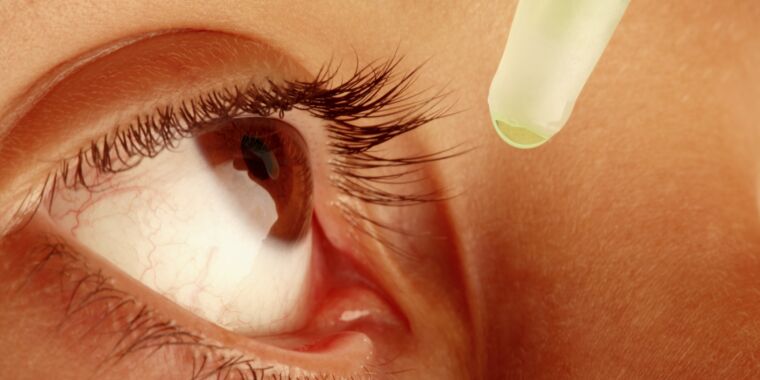
El fabricante de gotas para los ojos vinculado a un brote mortal de infecciones ampliamente resistentes a los medicamentos en los EE. UU. tuvo una serie de infracciones de fabricación, desde baba marrón en el equipo de llenado hasta la falta de medidas y sistemas básicos para garantizar la esterilidad, según un informe de inspección publicado. por la Administración de Alimentos y Medicamentos (PDF).
En febrero, el regulador advirtió a los consumidores que dejaran de usar inmediatamente gotas para los ojos y ungüentos para los ojos fabricados por Global Pharma, cuyos productos se vendían en los EE. UU. con las marcas EzriCare y Delsam Pharma y estaban disponibles a través de Amazon, Walmart, eBay y otros minoristas. Posteriormente, Global Pharma emitió retiros voluntarios de los productos.
Los investigadores de salud habían relacionado las gotas con casos de una enfermedad extremadamente resistente a los medicamentos. Pseudomonas aeruginosa cepa que nunca antes se había visto en los Estados Unidos. La cepa se identifica como VIM-GES-CRPA, que significa P. aeruginosa resistente a carbapenem (CRPA) con metalo-β-lactamasa mediada por integrón de Verona (VIM) y β-lactamasa de espectro extendido de Guayana (GES). Aunque las personas afectadas informaron haber usado múltiples marcas de gotas para los ojos, EzriCare fue la más común. Además, las pruebas realizadas por los Centros para el Control y la Prevención de Enfermedades e investigadores independientes han identificado la cepa del brote en botellas abiertas de lágrimas artificiales EzriCare.
Hasta el 14 de marzo, 68 personas en 16 estados han sido infectadas con la cepa, informan los Centros para el Control y la Prevención de Enfermedades. Tres personas han muerto a causa de la infección, ocho han perdido la visión y a cuatro les han extirpado quirúrgicamente los globos oculares.
En febrero, la FDA señaló que Global Pharma tenía varias violaciones de fabricación, pero el informe de inspección establece el alcance de las deficiencias. El informe de 14 páginas proviene de una inspección de 10 días de las instalaciones de fabricación de Global Pharma en Thiruporur, India (justo al sur de Chennai, en el estado de Tamil Nadu) que tuvo lugar entre el 20 de febrero y el 3 de marzo.
El informe de inspección describe once «observaciones» de fallas, con detalles específicos. La primera es que Global Pharma no pareció molestarse en verificar si sus gotas para los ojos, que la compañía afirmaba que eran estériles, eran realmente estériles. No hay «datos de validación adecuados para demostrar» que el sistema de filtración de la compañía puede «esterilizar de manera confiable» las gotas para los ojos, según el informe de inspección de la FDA.
Deficiencias mortales
La instalación, al parecer, estaba preparada para producir productos contaminados. Los inspectores de la FDA señalaron que Global Pharma no verificó que los componentes de las soluciones, comprados a los proveedores, fueran estériles para empezar. Y las áreas de la instalación donde se suponía que la solución se haría de forma aséptica, libre de contaminación, no eran aptas para producir productos estériles. Es decir, las paredes, los techos y los pisos no eran superficies lisas y duras que pudieran esterilizarse fácilmente como deberían ser. En cambio, había grietas, clavos que sobresalían y agujeros en la pared. Pero, incluso si el área se podía limpiar, los protocolos de limpieza de la empresa también eran deficientes, señaló el informe.
Los inspectores de la FDA notaron problemas con la limpieza y el mantenimiento de la maquinaria, lo que podría haber dado lugar a una contaminación cruzada con otros productos fabricados en la instalación. En el segundo día de inspección, un inspector también notó un «depósito grasiento de color negro y marrón» en partes de la máquina llenadora, y el libro de registro del equipo de la instalación señaló que no se había limpiado en casi un mes. Unos días después, un gerente le dijo al inspector que no había «ningún procedimiento para limpiar» la máquina llenadora.
También faltaba el monitoreo ambiental de la contaminación en la instalación, encontró el informe. Y la esterilidad del empaque primario, incluidas las tapas de las botellas, no se verificó antes de que se usaran. Una vez que se embotellaron las gotas para los ojos, la fórmula no contenía un conservante para evitar la contaminación microbiana y los lotes se enviaban a los EE. UU. sin pasar por la unidad de control de calidad.
Una funcionaria de los CDC le dijo a Ars anteriormente que temía que el brote de VIM-GES-CRPA en los EE. UU. genere más infecciones y resistencia a los medicamentos. «Hasta la fecha, ampliamente resistente a los medicamentos Pseudomonas con genes que propagan rápidamente la resistencia, como VIM y GES, han sido raros en este país», dijo Marissa Grossman, oficial del servicio de inteligencia epidémica de los CDC. «La introducción generalizada de la cepa del brote… amenaza con socavar los esfuerzos para prevenir estos brotes altamente resistentes. organismos se vuelvan más comunes», dijo.
En marzo, la FDA publicó avisos de retiro de otros dos tipos de gotas para los ojos, de Pharmedica y Apotex, por problemas de no esterilidad. Los productos, ambos enumerados como fabricados en América del Norte, no se han relacionado con el brote de VIM-GES-CRPA.